Spermatozoa bulunamayan
azoospermi olgularında
alternatif gametlerin kullanımı ve
klonlama
İnfertilitenin gerek araştırılması gerekse tedavisinde büyük ilerlemeler kaydedilmiş olmasına rağmen, hastaların hala önemli bir kısmında gebelik sağlanamamaktadır. Olguların büyük bir kısmında spermatogenez yetmezliği ve/veya oosit yaşlanması sorumlu tutulmaktadır. Donör gametlerinin kullanımı legal, etik ve sosyal bazı önemli problemleri de beraberinde getirmiş olup, çiftlerin bu yolu seçmelerini kısıtlamaktadır. Ancak, günümüzde üreme teknolojisinde, özellikle eksperimental çalışmalarda kaydedilen hızlı ilerlemeler sayesinde gametler için alternatif kaynak bulunması ve bu şekilde çiftlerin kendi genetik materyallerinden doğacak bir çocuk sahibi olabilmeleri konusunda umut doğmuştur. ICSI kullanılarak insan oositlerinin spermatid, hatta sekonder spermatosit gibi immatür sperm prekursörü hücreler ile fertilizasyonu yapılarak sağlıklı bebekler dünyaya getirilmiştir. Gebeliklerin bir kısmı in vitro şartlarda yapılan spermatogenezden elde edilen spermatidler kullanılarak başarılmıştır. Farelerde primer spermatositler bile normal embriyogenez oluşturabilmektedir. Spermatogoniumun hayvanlarda testise transplantasyonunun, hatta ksenotransplantasyonun başarılmış olması, spermatogenez arresti bulunan veya kanserli erkeklerin tedavilerinde bunun alternatif bir kaynak olabileceğini ortaya koymaktadır. Somatik hücrelerin nukleuslarının oosit içine transplante edilmeleri ve burada haploid hale getirilebilmeleri, yaşa-bağlı anöploidinin üstesinden gelinmesinde ve bu sayede sağlıklı oositler elde edilmesinde pratik bir yol olarak görülmektedir. Ama her şeyden önemlisi burada tanımlanan yöntemlerin insanda uygulanmasına başlanılmadan önce güvenlirliliklerinin ispatlanmasıdır. Bu yazıda ayrıca, bahsedilen uygulamalarda sitoplazma kalitesi ve genetik imprinting'in etkileri de tartışılmaktadır.
Yaklaşık 20 yıl öncesine kadar çocuk sahibi olabilmek ancak doğal yolla gerçekleşebiliyordu. Önceleri üremeye yardımcı teknikler (ÜYT) sadece donör spermi ile başarılı sonuçlar verirken, homolog sperm kullanıldığında başarı düşük kalmaktaydı. 1978'de insanda IVF ile ilk kez gebeliğin elde edilebilmesi ile bu alanda radikal değişiklikler başladı. Yine de infertil çiftlerin yaklaşık %40'ı sperm kalitesindeki bozukluk nedeniyle çocuk sahibi olamamaktadır. IVF ile başarılı olunamayan olgular içinse 1992'de Palermo tarafından insanda ilk kez uygulanan ICSI ile önemli oranda gebelik şansı doğmuş oldu. Çalışmalar ilerledikçe ICSI azoospermik olgularda da başarıyla kullanılmaya başlanıldı. Gerek etik bir sorun olmaması gerekse donör spermine ihtiyaç bırakmaması nedeniyle ICSI artık geniş çapta kullanılan bir yöntem haline gelmiştir.
Yine de IVF ve ICSI, sorunları tamamen halletmiş değillerdir. Artık kadının her yaşta çocuk sahibi olabilmesi gündeme gelmiştir. Bu özellikle 40 yaş üzeri kadınlarda önemli bir problem teşkil etmektedir. Her ne kadar ileri yaş kadınlarda oosit bağışlanması ile çocuk sahibi olunabiliyorsa da, çiftlerin çoğu kendi çocuklarına sahip olmayı istemekteler ve üreme tıbbında günümüzde kaydedilen ilerlemeler sayesinde artık bu konu üzerinde çalışılmaktadır.
İleri yaş kadınlarda infertilite nedenleri arasında en önemli kısmı koit sıklığındaki azalma, primordial folliküllerde azalma ve özellikle yüksek orandaki oosit anöploidisi oluşturmaktadır. Metafaz II oositlerde, primer olarak mayoz I sırasında bivalent kromozomların ayrılamamasına (non-disjunction) bağlı ortaya çıkan anöploidi sıklığı, 25-34 yaş grubu için %4.9, 35-39 için %11.5 ve 40-45 arasındakiler için %29.8 olarak bulunmaktadır. İleri yaş kadınlarda düşük gebelik oranlarının en önemli nedenlerinden biri anöploididir. Çünkü genç oosit donörleri ile daha yüksek oranda gebelik elde edilebilmektedir. Şüphesiz ki, ileri yaş gebelikler doğan çocukta otozomal trizomi gelişmesi için predispoze bir faktördür.
Azoospermi ve oosit anöploidisi için tedavi arayışları, özellikle kendi genetik materyalleri ile çocuk sahibi olmak isteyen infertil çiftlerde, spermatozoa ve oosit için başka alternatif kaynakların bulunması konusunda araştırıcıları stimüle etmiştir. Bu amaçla son yıllarda klonlama üzerinde yoğun çalışmalar başlatılmıştır.
Spermatozoa yerine sperm prekürsörleri kaynakları
Spermatidler
Taze ejakulat spermatozoası ile yapılan ICSI'lerin etkinliği gözlendikten sonra, obstrükte epididimden toplanan spermatozoalar da ICSI'de kullanılmaya başlanmıştır. Ama obstrükte olmayan azoospermi olgularında spermatozoa ancak testislerden elde edilebilmektedir. Non-obstrüktif azoospermi olgularının önemli bir kısmında spermatogenezde maturasyon arresti söz konusudur. Bununla birlikte, maturasyon arrestinin tüm tubüllerde değil de bazı tubüllerde bulunuyor olması, diğer alanlarda ise normal spermatogenezin bulunması, maturasyon arrestli bu olgularda ICSI'de kullanılmak üzere spermatozoa elde edilmesini mümkün kılmaktadır. Oysa bazı Sertoli cell only sendromlu olgularda germinal aplazi tüm tubülleri tutabilmekte ve bunlarda hiçbir şekilde germ hücresi bulma olanağı kalmamaktadır.
Azoospermik olgularda spermatozoanın bulunamadığı durumlarda daha immatür germ hücrelerinin kullanılması ile gebelik elde edilmesi uğraşıları ilk olarak Ogura ve Yanagimachi (1993) tarafından eksperimental temelde başlatıldı. Oysa spermatogenezin gerekli bir sonucu haploidizasyondur, yani fertilizasyonun olabilmesi için önce germ hücresinin haploid hale gelmesi gerekmektedir. En erken oluşan haploid hücre round (yuvarlak) spermatiddir. Tavşan, hamster ve fare round spermatidleri mikroenjeksiyon ile veya elektrofüzyon yoluyla oosit içerisine verildikleri zaman, kendi DNA'larını replike edebilirler, syngamy oluşturabilirler ve komplet gelişmeyi sağlayabilirler.
Hayvanlarda elde edilen bu başarılı sonuçlar insanlarda da immatür spermatogenetik hücrelerin oosit içerisine enjeksiyonunu gündeme getirmiştir. Bu yolla round spermatidler kullanılarak yapılan ICSI (ROSI) neticesi fertilizasyon ve erken klivaj başarılabilirken, elongated (zamaya başlamış) spermatidler ile de sağlıklı bir çocuk doğurtuldu (Vanderzwalmen 1995, Fishel 1995, 1997). Arkasından round spermatidler ile de normal doğumlar bildirildi (Tesarik 1995, 1996). Ama round spermatidler ile yapılan ICSI neticesi fertilizasyon ve gebelik oranları çok düşük kalmıştır.
ROSI başarısının düşüklüğü bazı soruları tartışmaya açmıştır. Acaba elongated spermatidlerin başarısı round'lardan daha mı fazladır. Ayrıca round spermatidler kullanılırken bu hücrenin seçimi sırasında spermatosit, monosit ya da polimorf nuklear lökositlerin round spermatidlerden ayrımı da çok güç olmaktadır. Akrozomal granül her zaman kolay ayırd edilememektedir. Son zamanlarda mikroskopi tekniğinde bazı modifikasyonlar yapılarak, bu güçlüklerin giderilmesine çalışılmaktadır (Verheyen 1998).
Bir diğer problem ise oosit aktivasyonudur. Oosit aktivasyonunda tetik mekanizmayı başlatan sinyal kalsiyum olup, sperm-oosit füzyonu esnasında spermatozoa içerisinde bulunan bir faktör oosit içerisine kalsiyum çıkışını başlatır. ICSI başarısızlıklarının en önemli nedenlerinden birisi bu aktivasyonun gerçekleşememesidir. Yada spermin penetrasyonunu takiben suboptimal bir aktivasyonun olması fertilizasyonu belli bir kademede durdurur. Komple spermatogenez yetmezliği bulunan azoospermik erkeklerin testislerinden alınan spermatidlerde bu aktivasyonun gelişememesi, ROSI'de başarılı olunamamasının bir sebebi olabilir. Oysa spermatogenezi normal devam eden bir erkekten alınan round spermatid ile, aynı matür spermatozoada olduğu gibi, normal kalsiyum sinyal mekanizması gerçekleşebilmektedir. Anormal kalsiyum sinyal mekanizmasının ICSI ile oluşacak embriyolarda kromozomal anormalliğe de neden olabileceği ileri sürülmektedir (In't Veld 1995, Tesarik 1998).
Maturasyon arrestli hastalarda apopitotik germ hücrelerinin sık bulunması da ROSI'yi değişik mekanizmalarla bozabilir. Örneğin bu sırada aktive olan hidrolazlar, spermatid DNA'sında ve oosit aktive edici faktör gibi gelişimden sorumlu sitoplazmik faktörlerde hasara yol açabilir.
Matür spermatozoa enjekte edilmesine rağmen fertilize olamayan oositler yüksek oranda prematür kromozom kondensasyonu (PCC) gösterirler. Aynı olayı spermatidler kullanıldığında da görmekteyiz. Matür spermatozoalarda, kondanse olmuş -S-S- bağları ile stabilize hale getirilmiş protaminler, sperm nukleusunun oosit metafaz promoting faktör tarafından (MPF) erkenden metafaza girmesine mani olurlar. Oysa round spermatidlerde kromatin dağınık halde bulunmaktadır ve histon/protamin substitusyonu güçlükle başlayabilir. Buradan yola çıkarak, nuklear matüritenin önemi anlaşılmakta olup, aynı zamanda neden elongated spermatidlerin başarısının round spermatidlerden daha iyi olduğunu da izah eder. İlginç olanı, PCC her zaman bozuk gelişime neden olmaya bilirde. Örneğin, farelerde round spermatidin enjekte edildiği bir oositte aktivasyon gecikmesi olmasına rağmen, normal doğumun başarılmış olması bunu desteklemektedir. Oysa, PCC'nin immatür germ hücrelerinin, aynen somatik hücre nukleuslarında gözlendiği gibi, nuklear programının yeniden düzenlenmesinde yardımcı olmasının da söz konusu olabileceği ileri sürülmektedir (Wells 1999).
Her ne kadar ROSI ile sağlıklı bebekler dünyaya getirilmiş olsa da, ROSI'nin azoospermik erkeklerde bir tedavi biçimi olduğu bazı otörlerce kuşkuyla karşılanmaktadır. Silber ve Johnson'a (1998) göre elongated spermatidlerin bulunmadığı olguların hiç birisinde round spermatid de bulunmamaktadır. Maturasyon arresti ise daima bir mayoz defekti olarak ve daha ileri gelişim göstermeden bulunmuştur. Yani maturasyon arresti olayı sadece basit bir şekilde round spermatidin elongated spermatid durumuna geçememesi değildir. Buradan çıkan sonuç şudur: eğer spermatid kullanılarak ICSI yapılacaksa mutlaka matür spermatozoa ya da elongated spermatidin bulunması gerekmektedir. Aksi takdirde bulunan round spermatid ile yapılacak bir ICSI başarısız kalacaktır.
Diğer yandan eğer başarılı olduğu kanıtlanırsa ROSI, spermatozoa bulacağız diye geniş çaplı biyopsilemenin yol açacağı zararlara gerek bırakmayacak bir yöntemdir de. Çünkü TESE sırasında testiste iskemi gelişebileceği gösterilmiştir. Bu risk tunika albuginea üzerinde çok sayıda kesi yapıldığında daha da artmaktadır. Üstelik, spermatid basamağında komple maturasyon arresti de bulunabilir ve çoğu olguda geç spermatidler ve spermatozoa bulunmamasına rağmen sadece round spermatidler de bulunabilir. Bütün bu nedenler göz önüne alındığında, round spermatidler kullanılacaksa yöntemin düşük güvenilirliliği ve başarısının azlığı konularında hastaların mutlaka bilgilendirilmesi gerekmektedir.
Spermatositler
Sekonder spermatositlerin oosit içerisine enjekte edildiklerinde mayozlarını tamamlayacakları, farelerde gösterilmiştir. Matür oosit içerisine sekonder spermatositlerin verilmesini takiben 2. saatte bazı spermatosit nukleusları prematür kromozom kondensasyonu ve mikrotubulü oluşumu göstermektedirler. İçerisine spermatosit verilmiş oositlerin elektrik aktivasyonlarını takiben hem oosit hem de spermatosit kromozomları iki pronukleus ve iki polar cisim (biri anneden birisi de babadan) oluşturacak şekilde mayozlarını tamamlamaktadırlar. Böylece elde edilen 2 hücreli embriyolar anneye transfer edildiklerinde %24'ünde full-term gebelik başarılabilmiştir. Benzer şekilde, Sofikitis (1998), elektrikle aktive edilmiş oosit içerisine sekonder spermatosit nukleusu enjekte ederek, kadında ikinci polar cismin ve erkeğe ait bir pseudo-polar cismin dışarı atıldığını, sonuçta iki pronukleusun oluşarak embriyonun geliştiğini ve sağlıklı bir çocuk dünyaya geldiğini bildirmiştir.
Her ne kadar sekonder spermatositlere göre etkinliği daha düşük olsada, fare primer spermatositlerinin de matür ya da matüre olmak üzere olan oositler içerisine verildiklerinde mayozlarını tamamlayabilecekleri bildirilmiştir (Kimura 1998, Sasagawa 1998). Elektrik ile aktive edilmiş matür oositler içerisine primer spermatosit nukleusu enjekte edildiğinde, MII evresine ulaşmaktalar ve iki polar cisimlerini (oosit orijinli PbII ve spermatosit orijinli PbI) atabilmektedirler. Spermatositten gelen polar cisim bir diğer matür oosit içerisine verildiğinde ise erkek pronukleusu oluşabilmekte, ve artık haploid hale gelmiş olan bu primer spermatosit ile embriyo gelişimi başarılabilmektedir.
Benzer şekilde, primer spermatosit nukleusu MII oosit içerisine enjekte edilerek, artan MPF seviyesi sayesinde kromozom kondensasyonu indüklenerek spindle formasyonu gelişebilmektedir. Böyle oositler önce biri oosite diğeri spermatosite ait 2 polar cisim atmaktalar, ve elektrikle aktive edilir edilmez mayozlarını tamamlayarak iki pronukleus oluşturabilmekte ve iki yeni polar cisim yaparak dışarı atabilmektedir. Bununla birlikte, 2 hücre evresinde transfer edilen böyle 258 embriyodan sadece 2'si normal gelişim gösterebilmiştir (Sasagawa 1998).
Başarıdaki bu düşüklüğün nedenleri araştırılmaktadır. Mekanik manipulasyon, mediumların optimum olmaması veya yetersiz imprinting ve DNA onarımı belki de başarısız kalınmasının sorumlu faktörleridir. Primer spermatositlerle enjekte edilmiş oositlerde kromozomal anormalite sıklığının yüksekliği de etkili olmuş olabilir. Nukleusta haploidasyonun sağlanması için MII oositler yerine immatür oositlerin kullanılması ile biraz daha iyi sonuçların alındığı gözlenmektedir (Ogura 1998).
Henüz gelişim aşamasında olsa da, sıklıkla profaz sonunda ortaya çıkan (primer spermatosit evresinde) spermatogenetik arrest bulunan olgularda spermatositlerin kullanımının bir gün, iyi bir tedavi seçeneği olacağı kanısı vardır. Her ne kadar infertil erkeklerin %50'si ya zigoten evresinde sinaps (kromozom pairing) ya da geç pakiten evresinde desinaps (paired homologların erken separasyonu) anomalileri gösterseler de, özellikle sağlıklı hücreler seçilebilirse, spermatogenetik arrestin tedavisinde spermatositler gelecekte alternatif bir tedavi seçeneği olabileceklerdir. Gerçektende in vitro kültür, transmayotik farklılaşmasını başarmış sağlıklı hücreleri seçebilme olanağı vermekte, ve bu şekilde immatür germ hücrelerinin veya bunların nukleuslarının oosit içerisine direkt enjeksiyonlarına alternatif bir yöntem olma özelliği taşımaktadır (Tesarik 1998). Primer spermatosit evresinde maturasyon arrestine bağlı olgularda bu tekniğin kullanılmasını takiben, ilk 2 yavru doğurtulmuş olup, hiç birisinde sayısal ya da yapısal kromozom anomalisi ortaya çıkmamıştır (Tesarik 1999).
Genomik imprinting
Diploid hücrelerde allellerin eksklusyonu, bazı genlerin iki allelinden birinin inaktivasyonuyla sonuçlanmaktadır. Imprinting denilen maternal veya paternal allellerin bu şekilde inaktivasyonu olayı, DNA'larının sitozin rezidülerinin 5' pozisyonunda metilasyonu sonucu gerçekleşen bir epigenetik modifikasyon şeklinde oluşmaktadır. Sessiz kalan gen yeniden aktive olduğu zaman demetilasyon yoluyla bu olay tersine dönebilir. Eksprese edilmedikleri dokuların çoğunda dokuya spesifik genler metillenmişlerdir, eksprese edildikleri dokularda ise bir modifikasyona uğramazlar. Tersine, 5' CpG bölgesine bağlı evsahibi genler bütün dokularda metillenmemiş haldedirler. Metilasyon keza, kadın somatik hücrelerindeki inaktiv X kromozomu üzerinde bulunan genlerin represyonlarının idamesinde de rol alır.
Genomik imprinting normal gelişim için çok önemlidir. Gametogenez veya erken gelişim dönemi sırasında bozulması Prader-Willi ve Angelman sendromları gibi bazı genetik hastalıklara neden olabilir, ve çocukluk çağı malign tümörlerinin gelişimini uyarabilir. Memelilerin gelişiminde genomik imprinting'in önemi ilk olarak 1977'de anlaşılmıştır. Gen inaktivasyonu konusunda yapılan çalışmalarda kadında imprinte olan genlerin embriyonik büyümeyi, erkekte imprinte olan genlerin ise plasental büyümeyi sağladıkları ortaya konmuştur. Embriyo gelişiminin erken basamakları sırasında dramatik metilasyon değişikliklerinin oluştuğu gözlenmektedir. Erken blastomer DNA'larının çoğu metillenmemiştir, ve totipotensleri bununla ilgilidir. Ama, implantasyonu takiben yaygın bir de-novo metilasyon dalgası, evsahibi genler dışında genomun büyük kısmını değiştirir. Aberran metilasyon embriyo gelişimine zarar verir. Metiltransferaz ekspresyonu düşük olan bazı hayvanların embriyolarının miyadında gelişim gösteremedikleri gözlenmektedir. Diğer yandan, transgenic farelerde H19 geninin aşırı ekspresyonu geç dönem gestasyonel ölümlerine neden olmaktadır ve Snrpn gen (paternal imprinte olmuş allel) bölgesinde maternal duplikasyon farelerde postnatal ölümlere yol açmaktadır. Ayrıca, tümör supresor gen promotor'unun metilasyonu da tümör gelişimine katkıda bulunmaktadır.
Gametogenez sırasında imprinting olaylarının kesin zamanlaması tam kesinlik kazanmamış olmakla birlikte, bazı indirekt kanıtlar ileri sürülmektedir (Tycko 1997). ICSI'de immatür germ hücrelerinin kullanımı hangi evrelerde imprinting olayının inkomplet olduğunu ortaya çıkarmaya yardımcı olabilir. ROSI ile elde edilmiş olan fare embriyolarında, çok sayıda paternal ve maternal imprinte olmuş genlerin ekspresyonunda, kontrole göre bir fark bulunmadığı ortaya konmuştur. Her iki sekste de erken gelişim dönemlerinde germ hücrelerinde metilasyon farklılıkları gözlenmemiştir. Spermatogenez sırasında, muhtemelen primordial germ hücrelerinde veya replike olan gonositlerde, imprinting'de mayozdan önce silinme görülür. DNA metiltransferaz aktivitesine göre, imprinting'in tekrar gerçekleşmesinin geniş oranda preleptoten, leptoten ve zigoten evrelerinde ortaya çıkacağı savunulmaktadır. Ancak, round spermatidlerde rezidü metiltransferaz aktivitesi bulgusu, imprinting'in yalnızca mayozdan sonra tamamlanabileceğini düşündürmektedir. Bunun bazı minör elementleri spermiasyondan sonra bile inkomplet kalabilir, çünkü Pgk-2, ApoA1 ve Oct-3/4 gibi genlerin metilasyonları spermin epididimden geçişi sırasında gözlenmektedir.
Spermatogonium transplantasyonu
1994'de Brinster ve Zimmermann erkek stem hücrelerinin steril farelerde seminifer tubüller içerisine enjeksiyonlarını takiben testisde tekrar çoğalabileceklerini göstermişlerdir. Hatta bu yöntem ile fertil spermatozoalar bile elde edebilmişlerdir. Kolonizasyon, normal spermatogenezdeki kompleks hücre birlikteliğinin rekonstrüksiyonunda daima ümit verici bir ilgi alanı olmuştur. Nihayet, rat stem hücrelerinin fare seminifer tubüllerinde kolonize olup olmayacakları araştırılır hale gelmiştir.
Ratlardan alınan hücreler immün yetmezlikli fare testislerine transplante edildiğinde, farelerin epididmlerinde 110 günden sonraki bazı hayvanlarda normal morfolojide rat spermatozoaları elde edilmiştir (Clouthier 1996). Bir fare testisi içerisinde rat spermatogenezinin görülmesi, başka türlere ait stem hücrelerinin transplante edilebileceğini ispatlamış olup, insanda da stem hücreler kullanılarak ksenogeneic (başka türe ait) spermatogenezisin başarılabileceği ümidini doğurmuştur. Maymunda da otolog spermatogonial transplantasyonu takiben 4. haftada seminifer tubüller içerisinde spermatogenezis yeniden başlatılmıştır (Schlatt 1999).
İnsan spermatogoniumlarının ksenogeneic transplantasyonu ICSI ile birlikte uygulandığında, mayotik veya post-mayotik germ hücrelerinin kullanılmasına alternatif bir tedavi modeli olarak görülebilir. Örneğin, radyasyon sırasında veya kemoterapi verilirken hücre proliferasyonunun supresyonu ile stem hücrelerinin sensitivitesinin azaltılması amacıyla hormonal baskılama yöntemi her zaman başarılı olmamaktadır. Böyle olgularda germ hücrelerinin alınarak bunların sonradan seminifer tubüller içerisine yeniden verilmeleri, germinal epitelyumun yeniden hayatiyete geçirilmesinde, özellikle puberte öncesi hastalarda, potansiyel değerli bir yöntem olabilir.
Bir diğer husus ise insan spermatogenezinin bu işlem için yeterliliğidir. Çoğu hayvan ile karşılaştırıldığında insanda bu yeterlilik, muhtemelen spermatogenezin uzun sürmesi, germ hücre konsantrasyonunun düşüklüğü ve seminifer tubüllerin kapladığı testis yüzdesinin azlığı nedenleriyle, kısmen daha azdır. Ayrıca insanda, özellikle ikinci mayoz sırasında %36-45'lere varan önemli ölçüde germ hücre dejenerasyonu olmaktadır.
Her ne kadar insan spermatogoniumunun fare testisine transplantasyonu başarılmayı beklemekteyse de, bunun gerçekleşmesi insan spermatogenezinin araştırılmasında, kemoterapi veya radyoterapiye giren erkeklerde fertilitenin korunabilmesinde ve maturasyon arrestli olguların kesin tedavilerinde değerli bir teknik olabilir. Ayrıca, aynı ratlarda olduğu gibi insanda da spermatogoniumlar dondurularak saklanabilir ve bu teknik kullanılarak ileride gebelik sağlanılabilir. Örneğin kemoterapi sonrasında olduğu gibi, germ hücrelerini kaybetme tehlikesi ile karşı karşıya kalan erkeklerde dondurularak saklanan spermatogoniumların radyasyon uygulanmış testis içerisinde yeniden kolonizasyonu yapılarak elde edilecek spermatidler, ileride ICSI'de kullanılabileceklerdir de.
Bu güne kadar insanda germ hücrelerinin transplantasyonu başarılı sonuçlar vermemiştir (Reis 2000). İnsanda testis biyopsilerinden ya da orkiektomi materyallerinden izole edilen spermatogonium, spermatosit ve spermatidlerden oluşan miks hücre populasyonları W/Wv fare testislerine (sadece birkaç primitif evre germ hücrelerinin bulunduğu steril fareler) transfer edilmişlerdir. Bu şekilde insan donör germ hücrelerinin enjeksiyonu yapılan fareler, 48-230 gün takip edildiklerinde, farelerin testisleri içerisinde spermatogenez yeniden başlatılamamıştır (Reis 1999). İnsan spermatogoniumunun başka hayvanlara transplantasyonunun başarılı olabilmesi için, uygun bir alıcı hayvan türünün bulunması gerekmektedir.
Oosit kaynakları
Hayvanlarda denenen klonlama insanda da uygulanmaya çalışılmaktadır. Ama bir çok ülkede insan klonlaması yasaklanmıştır. Yine de, klonlamadan elde edilen yeni bilgiler ile nuklear transfer gibi teknikler üreme tıbbında bu gün karşılaştığımız önemli problemlere bir çözüm olarak görülmektedir.
Klonlamada anahtar evre bir karyoplastın (kromozom kompleksi) izolasyonu ve bununda nukleusu çıkarılmış bir ooplast (oosit sitoplazması) içerisine transferidir. Oositin nukleusu, bir cam mikropipet kullanılarak mikromanipülasyon ile ya da kimyasal tedavi ile çıkarılabilir. Sonra içerisine karyoplast enjekte edilir ve elektrik stimülasyonu verilerek veya viral ajanlar kullanılarak, nukleusu çıkarılmış alıcı ooplast ile bu karyoplastın füzyonu sağlanılabilir.
Embriyonik ve somatik hücrelerin kullanıldığı nuklear transplantasyon çalışmaları, sağlıklı bir embriyo gelişiminin başarılabilmesi için maturasyon promoting faktör (MPF) tarafından yönetilen nüklear bir yeniden programlanmanın gerekliliğini ortaya çıkarmıştır. MPF, hücre siklusunda major sitoplazmik kontrol faktörlerinden birisi olup, bir cyclin B, bir regülatör komponent ve katalitik bir subunit olan p34cdc2'den meydana gelir. Hücre siklusu esnasında p34cdc2'nin konsantrasyonu değişmez, halbuki cyclin'lerin konsantrasyonu değişir. Germinal vezikül parçalanmaya başlamadan hemen önce oosit sitoplazmasında MPF aktivitesi artmaya başlar, ve metafaz I (MI) süresince hep yüksek düzeyde kalır. Anofaz ve telofazda MPF tekrar düşmeye başlar, ama hücre MII'ye girdiğinde yeniden yükselir. Takiben, fertilizasyon ya da oosit aktivasyonu olur olmaz MPF'de hızlı bir düşme gözlenir. Transplantasyonda yüksek MPF aktivitesi taşıyan sitoplazma içerisine transfer edilen tüm nukleuslarda nukleus membranları parçalanır ve kromozomlar dekondense hale geçer. Elektrik uyarısı ya da etanol veya strontium içeren bir medyum ile muamele edilme gibi uygun bir artifisyal uyarı verilerek hücre siklusu yeniden başlatılır. Ancak, gelişecek hücrenin normal bir ploidi gösterebilmesi için, donör nukleusu ve alıcı sitoplazmasının içinde bulunduğu hücre siklusunun evresi de önemli bir faktördür. Donör nukleusun füzyonu için oosit aktivasyonunun zamanlamasını değiştirmek, her iki hücre siklusunun senkronizasyonunun sağlanmasında önemli olanaklar sunar.
İnsanda gebeliklerin en az %5'inde rastlanılan kromozomal anöploidinin bir sebebi olarak maternal yaş gösterilmektedir. Bu yaşa-bağlı anöploidi, yaşlı kadınlarda gözlenen yetersiz embriyo implantasyonunda esas nedendir, çünkü yaşlı infertil kadınlarda genç donör oositleri kullanıldığı zaman daha yüksek gebelik oranları elde edilmektedir. Mayozda anormal spindle gelişiminden yaşlı ooplazm sorumlu tutulmaktadır. Spindle anomalilerinde MI sırasında kromozom/kromatid segregasyonu bozuk olmaktadır. Böyle oosit defektlerinin düzeltilmesinde kullanılan bir yaklaşım, immatür oosit nukleusunun daha genç bir kadının sitoplazması içerisine transplantasyonudur (Zhang 1999).
Farelerde yapılan çalışmalarda, germinal vezikül (GV) karyoplastları izole edildikten sonra immatür alıcı sitoplazması içine transfer edilmişlerdir. Olguların %90'ından fazlasında oosit integrasyonunun yeniden sağlandığı izlenmiştir. Düzelen bu oositlerin %90'ı da bir polar cisimlerini dışarı atabilmişlerdir. Dışarı atılan bu polar cisimler incelendiklerinde hepsinin de normal bir kromozom yapısına sahip oldukları ortaya konmuştur. Bu çalışmalar göstermiştir ki, farelerde nuklear transplantasyon yüksek bir etkinliğe sahiptir ve genetik bir hasara yol açmamaktadır (Takeuchi 1999). Aynı yöntem insan oositlerinde uygulandığında ise oositlerde GV evresindeki düzelme oranları da yine %80'in üzerinde olmaktadır ama maturasyon oranları ancak %60'larda kalmaktadır. Buradaki düşük başarının nedeni in vitro maturasyon için kullanılan kültür ortamlarının kalitesinin yetersiz oluşuna bağlanmaktadır. Her ne kadar yaşlı bir nukleusun genç bir sitoplazma içerisine nakli neticesi gelişecek oosit hakkında daha fazla sitogenetik bilgiye ihtiyaç varsa da, bu teknik yaşa bağlı anöploidilerin tedavisinde tek tedavi seçeneği gibi görülmektedir. Teknik, oosit yaşlanmasının tedavisinde kullanılabilecek bazı düzenlemeler ile daha başarılı hale getirilebilir.
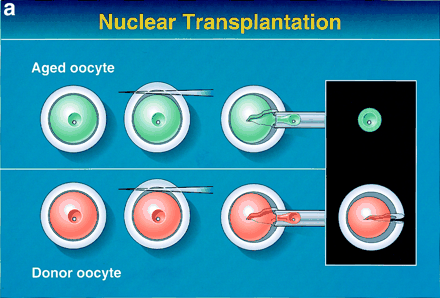
Şekil 1a. İmmatür bir oositin nukleusunun çıkarılması. Yaşlı bir oositten (yeşil) karyoplast, genç bir oositten ise (pembe) sitoplazma izole edilmekte.
Şekil 1b. Nakletme, elektrofüzyon ve yeniden yapılandırma. Genç oositin perivitellin aralığına karyoplast enjekte edilmekte. Bu oosit ise elektrik akımına maruz bırakılarak nukleus ile sitoplazmanın füzyonu sağlanmakta. Bu şekilde ,immatür oosit (gri) yeniden yapılandırılmış olmakta.
Son zamanlarda ooplazmik kusurların bulunduğu gelişimsel bozukluklu embriyoların normal gelişimlerinin sağlanmasında, sitoplazma transferi üzerinde çalışılmaktadır. Özellikle embriyo genomunun transkripsiyonunun minimal olduğu erken klivaj sırasında, zigotun normal gelişimini sürdürebilmesinde ooplazmik faktörlerin önemi üzerinde durulmaktadır. Bozulmuş bir embriyonun yeniden düzeltilmesi konusunda yapılan bir çalışmada, MII evresindeki bir donör oositinin sağlıklı ooplazması aspire edilerek, daha önce defalarca üremeye yardımcı teknikler denenmiş ama kötü embriyo gelişimi nedeniyle hep başarısız kalınmış bir hastanın oositleri içerisine enjekte edilmiş, ve bu yöntemle normal bebekler doğurtulabilmiştir (Cohen 1998). Ama bu yöntem MII oositlerde yapıldığı için, erken mayoz döneminde ortaya çıkabilecek kromozom dengesizliklerini düzeltmeyecektir.

Şekil 2a. Fare oositinden karyoplastın izolasyonu.

Şekil 2b. Nukleusu çıkarılmış bir oosit (ooplast) içerisine karyoplastın nakledilmesi.
Nuklear ve ooplazmik transferlerin önemli bir problemi, oositi kullanılacak olan 40 yaş üzerindeki yaşlı kadınların çok az sayıda oosit yapıyor olmalarıdır. Ancak, klonlama sayesinde (yaşlı kadının bir somatik hücresinin nukleusunun alınarak daha genç bir kadının nukleusu çıkarılmış oosit ooplazması içerisine taşınması) yeterli sayıda oosit elde edilebilir. Somatik hücrelerden canlı gametlerin elde edilmesinden özellikle yaşlı kadınlar, prematür ovaryan yetmezlikli kadınlar ve ovaryan cevap yetmezlikli kadınlar fayda göreceklerdir.

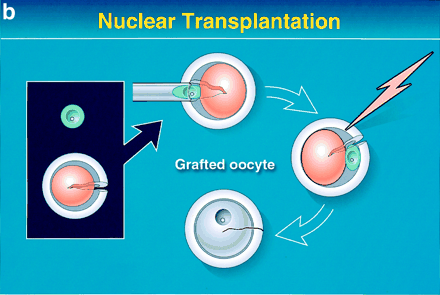
Şekil 3a. Oositlerin yeniden yapılandırılması. Hastanın genomunu içeren bir somatik hücre, nukleusu çıkarılmış bir germinal vezikül (GV) ooplastı içerisine nakledilerek, bu oosit yeniden yapılandırılabilir.

Şekil 3b. İmmatür bir oositin nukleusunun çıkarılması. Genç, immatür bir oositin nukleusu çıkarılarak, sitoplast (pembe) elde edilebilir.

Şekil 3c. Nakil, elektrofüzyon, yeniden yapılandırma ve haploidizasyon. Somatik hücre nukleusu (karyoplast şekline izole edilmiş, şekil 1) genç oositin perivitellin aralığına nakledilir. Bu oosite elektrik akımı uygulanarak nukleus ile sitoplazmanın füzyonu sağlanılır. Sonuçta metafaz I evresinde bir oosit (gri) elde edilmiş olunur, ve bu da birinci polar cismini (gri) atar.
Germinal vezikül evresindeki bir oositin sitoplazması, gerek germ hücrelerinden gerekse farklılaşmış somatik hücrelerden alınan nukleuslarda mayoz benzeri redüksiyon bölünmesini başlatabilme kapasitesine sahiptir (Kubelka 1997). Her ne kadar somatik hücre nukleusunun haploid hale getirilmesi işlemi klonlamaya benzer görülse de, sonuçta meydana gelen haploid oositlerin biparental progeny yapabilmesi için paternal gamete de ihtiyacı vardır. Yani somatik hücre nukleusunun kromozom sayısı in vitro şartlarda yarıya indirildikten sonra, her iki ebeveyne ait genetik materyal ile bir embriyo oluşabilmesi için oosite de ihtiyacı bulunmaktadır. Klonlamada ise tek hücre genomu yeterli olmaktadır. Takeuchi 1999'da immaür oosit içerisine somatik hücre nukleusu enjekte ederek somatik hücreyi haploid hale getirmeyi başarmışdır.
Bütün bunların yanısıra, yeni yapılandırılan oosit içerisindeki sentrozomun fertilizasyon ve embriyo klivajı üzerine etkisinin daha geniş kapsamlı araştırılması gerekmektedir. Ayrıca, somatik hücrenin in vitro kültürü ile elde edilen bir gametin imprinting procesinin, sperm veya oositten gelen nukleus ile uyuşup uyuşmayacağı da henüz bilinmemektedir. Diğer yandan, somatik hücre nukleusu nakli ile doğurtulan koyunlarda telomer boyunun kısa bulunması nedeniyle, somatik hücrelerden elde edilerek doğacak bir çocuğun yaşam süresi ve kalitesi üzerine bu yöntemin nasıl etkileri olur, araştırılması gereken bir diğer konudur.
Hayvanlarda yapılan klonlama işleminde epigenetik ve sentrioler hatalardan dolayı embriyo ve fötus ölüm oranlarının yüksek seyretmesi, fertilizasyon için kullanılmak üzere yeni bir oosit oluşturmak amacıyla somatik hücre haploidasyonu yapılan hücrelerde de aynı sonuçlar ile karşılaşılabileceği olasılığını düşündürmektedir. Ama spermin oosit içerisine girişi ve sperm fonksiyonları bu sonuçlar üzerine etkili olacaktır, çünkü bu yöntemde (sperm nukleusunun oosit içerisinde haploidizasyonu işlemi) basit bir klonlamadan farklı olarak tamamen yeni bir sistem yaratılmaktadır. Yakın tarihte, 4 hücre evresindeki fare embriyosundan alınan metafaz nukleusları kullanılarak yeni fare klonları oluşturulmuştur (Kwon ve Kono 1996). Bu klonlamanın sonuçları (blastosiste kadar embriyo gelişme oranı %83, bunun %57'sinde ise canlı doğum başarılmıştır) somatik hücre nukleusu kullanılan teknikden daha iyi olarak bildirilmiştir. Bütün bu sonuçlar ortaya koymaktadır ki, embriyo gelişimini ve düzgün genomik imprinting'i sürdürebilmede sitoplazmanın etkinliği, fertilize olmuş embriyolar ile partogenetik 1 hücreli embriyolar arasında belirgin farklılık göstermektedir. Ancak şu anda fötus kayıplarının nedenleri tam olarak anlaşılıncaya ya da bu yöntemin faydası eksperimental çalışmalarla ispatlanıncaya kadar, erkekte adult nukleusların kullanılması işlemleri ertelenmelidir.
Sitoplazmik implikasyonlar
Trombositler ve oositler dışında insan dokularının hepsinde her mitokondri 2-10 adet mitokondrial DNA (mtDNA) kopyası içermektedir. Oositlerde ise her mitokondride sadece 1 adet mtDNA kopyası bulunur. mtDNA'nın mutasyonlara olan hassasiyeti nuklear DNA'dan 20 kat daha fazladır, çünkü mtDNA reaktif oksijen radikallerinin oluşum yerine daha yakın lokalizasyonda bulunur ve mtDNA içinde koruyucu histonlar bulunmamaktadır. Mitokondri, kendi DNA'sının oksidatif hasarlarını onarabilme özelliği taşır. Genom boyunca mutasyon oranları değişir. Bazı bölgeleri nuklear DNA'nınkine benzer şekilde nukleotid substitusyon (yenileme, destekleme) hızına sahipken, nukleusta bulunan DNA'ya göre, sinonim bölgeler ve küçük rRNA 20 kat, tRNA ise 100 kat daha hızlı mutasyona uğramaktadırlar. Bazı hastalık durumlarında hastanın hücreleri mutant ve wild-tip (normal) mtDNA'ları bir arada taşımaktadırlar. Hücrelerin bu heterojen durumlarına heteroplazmi adı verilir. Pür mutant ya da pür normal mtDNA içeren homojen hücre durumlarına ise homoplazmi denir. Mitokondrial hastalıkların fenotipik ekspresyonlarında önemi bulunan bir faktör, normal ve mutant mtDNA'ların birbirlerine göre oranlarıdır. Ayrıca, mutant mtDNA dozunun fenotipin şiddeti üzerinde de önemli etkisi vardır. Mutant mtDNA düzeyleri dokudan dokuya farklı olup, organın oksidatif metabolizması ile ilgili olarak zamanla değişim de gösterir.
Nuklear DNA'nın aksine mtDNA daima maternal geçiş gösterir. Erken gelişim sürecindeki ve embriyo dayanıklılığının anne yaşına bağlı düşüşündeki rolleri nedeniyle mtDNA son yıllarda dikkat çeker duruma gelmiştir. Ayrıca mitokondri, bir çok herediter hastalığın da kaynağıdır. İnsanda mtDNA'nın segregasyonu ve kalıtabilirliliğini kontrol eden mekanizmalar tam anlamıyla anlaşılmış değildir.
Mitokondrial hastalıkların geçişi, genomu maternal kaynaklı olmuş olsa bile, hep aynı şekilde olmaz. mtDNA mutasyonu, maternal geçişli nokta mutasyonları şeklinde gelişebileceği gibi, familiyal bir geçiş olmasa bile de novo yolla da oluşabilir. Mitokondrial hastalıklar, mtDNA'da değişik delesyonlara neden olan otozomal dominant kalıtım örneği gösterebilirler. Veya, belirgin sitokrom oksidaz yetmezliğine yol açan otozomal resesif bir kalıtım da olabilir. Bir diğer kalıtım şeklide X'e bağımlı geçişdir.
Anneden çocuğa geçen mutant mtDNA oranı genetik özelliklere bağlı olarak değişiklik gösterir. Örneğin, erken embriyogenez sırasında germ hücreleri gelişirken mitokondri sayısı 100 kat artar (oogonium başına 1000'den oosit başına 100.000'e çıkar). Oysa aynı dönem içinde mtDNA'daki artış sadece 10 kattır (10.000'den 100.000'e). Sonuç olarak, her bir organel, 5-10 yerine ancak 1 adet mtDNA molekülü almış olur. Böylece geç dönem oogenezde ancak az sayıda mtDNA molekülü (yaklaşık 100.000 mtDNA molekülü) replike olarak, komplet sitoplazmik genotip düzeyine erişmiş olur. Bu tek molekül restriksiyon/amplifikasyon olayı yaşlanma sırasında mtDNA birikimine karşı, ki bu birikim oositler içinde de görülür, gereken bir çözümdür. Klivajdaki mitoz bölünme sırasında ve sonrasında, hem mutant hem de normal mtDNA yeni oluşan hücrelere düzensiz biçimde dağılırlar ve bu hücrelerde ileride fötus ve onun germ hücrelerini oluşturacaktır.
Günümüzde mitokondrial hastalıklarının etkili bir tedavisi yoktur. Normal mtDNA'nın mutasyona uğramış mtDNA taşıyan bir hücre içerisine sitoplazma füzyonu metodu kullanılarak taşınmasını takiben, anormal mtDNA'nın patolojik düzeyin altına dilüsyonu, defektif mitokondrinin hem biyokimyasal hem de morfolojik fenotiplerinin düzeltilmesinde etkin bir yol olacağı savunulmaktadır (Kagawa ve Hayashi 1997). Aynı mantıkla, insan germ hücrelerine nuklear transplantasyon yapılarak normal mitokondri elde edilmesinde bu teknik, en azından nokta mutasyonu bulunan hastalıklarda, çekici bir tedavi alternatifi olarak da düşünülebilir. Teorik olarak, sağlıklı donör sitoplazması kullanılarak oositlerin yenilenmesi defektif mtDNA geçişini de azaltabilecektır. Ancak, transplante edilen nukleus ince bir sitoplazma tabakasını da birlikte taşıyacağından, değişik sayıda mitokondrinin bu yolla taşınması da söz konusu olabilir (Takeuchi 1999). Bununla birlikte, içinde ihmal edilecek kadar az mitokondri taşıyan 1. polar cisim karyoplazması kullanılarak mtDNA geçişinin minimale indirilmesiyle bu sorun halledilebilir (Tsai 1999). Birinci polar cismin, nukleusu çıkarılmış matür fare oositi içerisine ICSI yöntemiyle enjeksiyonunu takiben, singami oluşturulmuş ve normal bir yavru dünyaya getirilmiştir (Wakayama ve Yanagimachi 1998).
mtDNA replikasyonu ve ekspresyonu için gerekli olan hemen hemen bilinen bütün aktiviteler nukleus tarafından kodlanan gen ürünleridir. Bu nedenle bu iki hücre içi kompartımanının iletişim içerisinde bulunması gerekir. Perinuklear bölgeye daha yakın bulunan mitokondrilerin nukleustan uzakta bulunanlara göre daha erken evrede replike oldukları ya da replikasyonu başlattıkları, sonuçta oluşacak hücrelerde daha yüksek oranda karyoplast kaynaklı mitokondrial genotip bulunduğu gözlenmiştir (Davis ve Clayton 1996). Aynı gözlem, farelerde pronuklear transplantasyon ve takiben karyoplast kaynaklı mtDNA elde etme çalışmaları ile de desteklenmiştir (Meirelles ve Smith 1998). Ayrıca, diğer bazı türlerde de perinuklear mitokondrilerin daha aktif replike olarak fötusun somatik hücrelerine dağıldıkları, oysa subkortikal yerleşimli grubun ise primordial germ hücreleri içinde lokalize kaldıkları gözlemlenmiştir (D'Herde 1995).
Karyoplast kaynaklı mitokondrilerin replikasyon üstünlüğü hayvanlarda kanıtlanmış olmakla birlikte, bunu insanda uygulamadan önce türler arasındaki farklılıkların çözümlenmesi gerekmektedir. Yakın tarihli bir çalışmada nuklear transfer ile oluşturulan hayvanlarda, alıcı hücrenin sitoplazmasından alınan mtDNA genotipinin dominant mtDNA kategorisini oluşturduğu bildirilmektedir (Takeda 1999). 21 hayvandan 20'sinin genotipi alıcı hücrenin sitoplazmasındaki mtDNA'nınki ile aynıydı.
Nuklear transplantasyon ile elde edilen çocukta karyoplast kaynaklı mtDNA'nın kesin katkısı nedir? Germinal vezikül karyoplastı kullanılan nuklear transplantasyon olgularında, maternal mutant mtDNA'nın geçişi gerçekten azalmaktamıdır? mtDNA dağılımının önceden bilinememesi ve fenotipik ekspresyonda eşik değerin değişken olması, bu konuda kesin bir kanıya varılmasını önlemektedir.
Sitoplazma ve nukleusun oosit içine transferi güvenilir ve etkin bir yöntem olarak bulunursa, IVF ile sonuç alamayan kadınlarda, kendi genetik materyali ile çocuk sahibi olma konusunda yeni bir ufuk açılmış olacaktır. Embriyonun gelişim potansiyelini düzeltmeye yönelik bir tedavi şekli olarak sitoplazma transferi, doğacak çocuğun genetik yapısı üzerinde çok az etkiye neden olacaktır, çünkü burada çok az mtDNA olaya karışmaktadır. Nuklear transplantasyon yönteminde ise yeniden yapılandırılan oositin her iki ebeveyne ait özellikler taşıması sosyal, psikolojik ve legal önemli tesirlere sahip olabilir. Donör ve alıcı mitokondrilerinin doğacak çocuktaki katkılarını kesin olarak anlamak için karyoplast içerisinde nakledilen mitokondrinin ve perinuklear mtDNA'nın tercihli replikasyonunun önemlerinin daha iyi araştırılması gerekmektedir.
Sonuç
Alternatif gamet kaynakları sadece bir bilim saplantısı değil, aynı zamanda gerçek bir ihtiyaçtır da. Günümüzde manipülasyonların çoğu, erkekte üremeye yardımcı tekniklerin kullanılmasında akut bir major tesirde bulunacak görünümü vermemektedir. Ancak, öncelikle çocuğun genetik olarak normal olduğunu ve yöntemlerin hayvanlarda test edildikten sonra güvenilirliliklerinin ispatlanması öncelikle kesin olarak ortaya konmalı. İleride yapılacak çalışmalar bu konuda cesaret verici olacaktır.
Azoospermik erkeklerde immatür germ hücrelerinin kullanımı günümüzde çoğu olguda tek tedavi olasılığı olarak durmaktadır. Her ne kadar bu yöntemin başarısı düşük olsa da, ROSI ile sağlıklı bebekler de bildirilmektedir. Demekki singami için sperm oluşumunda morfolojik basamakların hepsinin tamamlanmasına mutlak gerek yoktur. Eksperimental olarak primer ve sekonder spermatositlerin kullaılmasıyla, insanda ise sekonder spermatositin kullanıldığı bir çalışmada, spermatogenetik hücre prekürsörlerinin normal gelişimi sağlayabildikleri artık bilinmektedir. Diğer yandan, immatür germ hücrelerinin kullanımı yetersiz genetik imprinting, yaşam sürecinin izah edilemiyen kısalığı ve bazı çocuklarda, özellikle ileri derece immatür germ hücreleri (primer spermatositler gibi) kullanıldığı zaman doğan fare yavrularında görülen gelişim geriliğinin sonuçları konularında önemli tartışmalar ortaya çıkarmıştır.
İnsan spermatogoniumunun ksenogenik testiküler transplantasyonunun spermatogenetik arrest olgularının tedavisindeki değeri bir gün ispatlanabilecektir. Günümüzde fare seminifer tubülleri içerisinde insan spermatogoniumlarının çoğaltılamaması, daha uygun bir hayvan modeli bulunması gereğini ortaya çıkarmıştır. Oysa maymunlarda otolog spermatogonium transplantasyonu yapıldığında seminifer tubüller içerisinde spermatogenez başlatılabilmiştir (Schlatt 1999). Buda göstermektedirki, spermatogoniumların otolog transplantasyonu, onkolojik hastalarda kemoterapi yada radyoterapiden sonra, daha önce dondurularak saklanmış kendi stem hücreleri kullanılarak spermatogenezin yeniden başlatılabilmesini mümkün kılabilir.
Nuklear transplantasyonun yüksek etkinlikte bir yöntem olduğu farelerde gösterilmiş, ve kullanılan oositlerin %90'ından fazlasında bir polar cisim atılmış olup, kromozomal yapının normal olduğu gözlenmiştir. İnsan oositleri kullanıldığında ise, maturasyon oranları daima düşük kalmaktadır. Bunu nedeni belkide oositlerin in vitro maturasyonunda kullanılan tekniğin yetersiz kalmasıdır. Her ne olursa olsun, nüklear transplantasyonun, özellikle hormona yetersiz yanıt veren kadınlarda ve yaşlılarda görülen yaşa-bağlı anöploidinin tedavisinde çekici bir yöntem olduğu elbette ortaya konulacaktır.
Gametlerin manipülasyonu ile, teorik olarak somatik hücrelerin nukleuslarının çıkarılarak haploid hale getirilmeleri her yaş ve her zaman için mümkün olabilecek bir uygulama haline gelebilir. Ama somatik hücre haploidizasyonunun potansiyel klinik değerinden emin olmak için, işlenmiş olan oositin genetik değerlendirimi kadar sentrozomun da iyi yorumlanması gerekmektedir.
Son olarak, doğacak çocuğun mitokondrial fenotipinin meydana gelmesinde karyoplast-kaynaklı mtDNA'nın rolü kesin olmamakla birlikte, rutin bir uygulama haline gelmeden önce karyoplast transferinin etik ve sosyal etkileri de göz önüne alınmalıdır.
Tsai MC, et al: Opinion: Alternative sources of gametes: reality or science fiction? Hum Reprod 2000: 15: 988'den özetlenmiştir.